
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Última modificación 2025-01-22 16:57.
Ciencias ambientales para Tontos
Cuando dos átomos se unen en una enlace covalente , forman una molécula que comparte electrones. A diferencia de lo iónico vínculo , ninguno de los átomos en un enlace covalente pierde o gana un electrón; en cambio, ambos átomos usan un par de electrones compartidos.
Además, ¿qué son los términos simples de enlace covalente?
Enlaces covalentes son químicos cautiverio entre dos átomos no metálicos. Un ejemplo es el agua, donde el hidrógeno (H) y el oxígeno (O) vínculo juntos para hacer (H2O). Una capa exterior completa suele tener ocho electrones, o dos en el caso del hidrógeno o el helio. Enlaces covalentes están formados por átomos que comparten electrones de valencia.
Posteriormente, la pregunta es, ¿qué es un enlace iónico para maniquíes? Ciencias ambientales para Tontos Para formar moléculas, los átomos deben intercambiar o compartir electrones de su capa externa de electrones para crear atómicos. cautiverio . Un enlace iónico ocurre cuando un átomo le da un electrón a otro átomo. Los átomos unidos entre sí de esta manera se denominan iónico compuestos.
Simplemente, ¿cómo se describe un enlace covalente?
A enlace covalente , también llamado molecular vínculo , es un químico vínculo que implica el intercambio de pares de electrones entre átomos. Estos pares de electrones se conocen como pares compartidos o vinculación pares, y el equilibrio estable de fuerzas atractivas y repulsivas entre átomos, cuando comparten electrones, se conoce como Unión covalente.
¿Qué es un enlace covalente y dar ejemplos?
Ejemplos de de compuestos que contienen solo enlaces covalentes son metano (CH4), monóxido de carbono (CO) y monobromuro de yodo (IBr). Unión covalente entre átomos de hidrógeno: dado que cada átomo de hidrógeno tiene un electrón, pueden llenar sus capas más externas al compartir un par de electrones a través de un enlace covalente.
Recomendado:
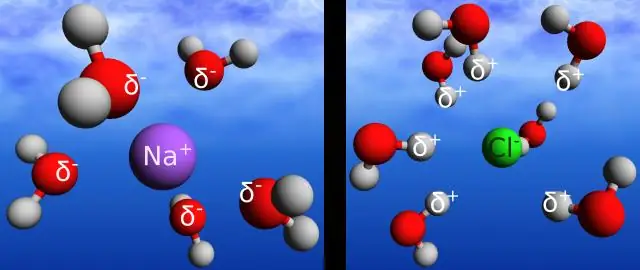
¿Contiene NaCl un enlace covalente apolar?

Sí, el NaCl es un enlace iónico que lo hace polar. La diferencia en electronegatividades es lo que hace que un enlace sea polar o no polar. Si dos átomos en un enlace tienen la misma electronegatividad (por ejemplo, que consta de dos de los mismos átomos), el enlace es no polar, ya que ambos átomos tienen la misma atracción por los electrones
¿En qué se diferencia un enlace covalente de un cuestionario de enlace iónico?

La diferencia entre un enlace iónico y uno covalente es que se forma un enlace covalente cuando dos átomos comparten electrones. Los enlaces iónicos son fuerzas que mantienen unidas las fuerzas electrostáticas de atracción entre iones con carga opuesta. Los enlaces iónicos tienen una diferencia de electronegatividad mayor o igual a 2
¿Cuál es la diferencia entre la energía de enlace y la energía de disociación de enlace?

La principal diferencia entre la energía de enlace y la energía de disociación de enlace es que la energía de enlace es la cantidad promedio de energía necesaria para romper todos los enlaces entre los mismos dos tipos de átomos en un compuesto, mientras que la energía de disociación de enlace es la cantidad de energía necesaria para romper un enlace en particular en la homólisis
¿Es un enlace de hidrógeno lo mismo que un enlace covalente?
Enlace de hidrógeno es el nombre que se le da a la interacción electrostática entre la carga positiva en un átomo de hidrógeno y la carga negativa en el átomo de oxígeno de una molécula vecina. El enlace covalente es la interacción electrostática entre dos átomos en la misma molécula
¿Qué enlace covalente consta de 2 electrones compartidos?

Los enlaces covalentes pueden ser enlaces simples, dobles y triples. Los enlaces simples ocurren cuando se comparten dos electrones y se componen de un enlace sigma entre los dos átomos. Los dobles enlaces ocurren cuando cuatro electrones se comparten entre los dos átomos y consisten en un enlace sigma y un enlace pi
