
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Última modificación 2025-01-22 16:57.
El Boltzmann ecuación
Microestados es un término que se usa para describir el número de diferentes arreglos posibles de posición molecular y energía cinética en un estado termodinámico particular. Un proceso que da una incrementar en el número de microestados por lo tanto aumenta los entropía.
La gente también pregunta, ¿qué reacción produce un aumento de la entropía?
(5) Cualquier químico reacción ese aumenta el número de moléculas de gas también aumenta la entropía . Un quimico reacción ese aumenta el número de moléculas de gas sería un reacción que vierte energía en un sistema. Más energía te da más entropía y aleatoriedad de los átomos.
En segundo lugar, ¿cómo saber si la entropía aumenta o disminuye? A disminución en el número de lunares en el lado del producto significa menor entropía . Un incrementar en el número de moles en el lado del producto significa mayor entropía . Si la reacción involucra múltiples fases, la producción de un gas típicamente aumenta los entropía mucho más que cualquiera incrementar en moles de un líquido o un sólido.
Además, ¿cómo se calcula el aumento de entropía?
La entropía aumenta a medida que pasa de sólido a líquido a gas, y puede predecir si entropía el cambio es positivo o negativo al observar las fases de los reactivos y productos. Siempre que haya un incrementar en lunares de gas, entropía voluntad incrementar.
¿La entropía es positiva o negativa?
La reacción ocurrirá, como en una reacción exotérmica H es negativo , y si el entropía aumenta, entonces S es positivo , entonces: Total entropía el cambio es positivo , por lo que la reacción es factible. La reacción nunca puede ocurrir, ya que H es positivo y S es negativo : El total entropía el cambio es negativo y entonces la reacción no puede ocurrir.
Recomendado:
¿Qué significa aumento de pH?

Aumentar el pH significa que los iones OH- son. D. Disminuir el pH significa que los iones OH- son. La mayoría de los iones H +: pH = 4; o pH = 5. Respuesta
¿Qué es claramente visible con un aumento de 400x?

Con un aumento de 100x, podrá ver 2 mm. Con un aumento de 400x, podrá ver 0,45 mm o 450 micrones. Con un aumento de 1000x, podrá ver 0,180 mm o 180 micrones
¿Qué ecuación matemática muestra la relación expresada en la ley actual de Kirchhoff?

La representación matemática de la ley de Kirchhoff es: ∑ nk = 1Ik = 0 ∑ k = 1 n I k = 0 donde Ik es la corriente de k, y n es el número total de cables que entran y salen de una unión en consideración. La ley de unión de Kirchhoff tiene una aplicabilidad limitada en regiones, en las que la densidad de carga puede no ser constante
Cuando se reduce el volumen de una muestra de gas, ¿la presión de la muestra de gas?
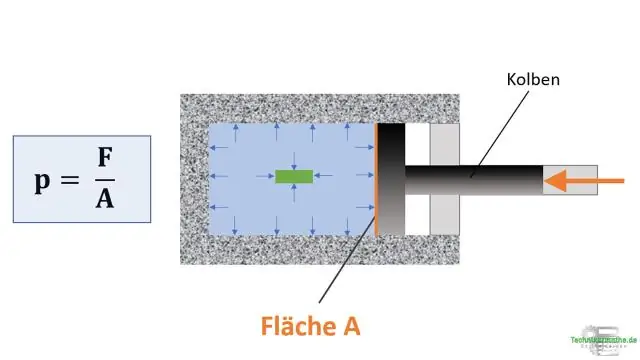
Presión decreciente La ley de los gases combinados establece que la presión de un gas está inversamente relacionada con el volumen y directamente relacionada con la temperatura. Si la temperatura se mantiene constante, la ecuación se reduce a la ley de Boyle. Por lo tanto, si disminuye la presión de una cantidad fija de gas, su volumen aumentará
¿Qué ecuación representa la línea que se muestra en la gráfica Y 2x?

La forma pendiente-intersección es y = mx + b, donde m es la pendiente y b es la intersección y. Esto hace que la ecuación de nuestra línea y = 2x + 0 o y = 2x
