
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:35.
- Última modificación 2025-01-22 16:57.
Continuando con el nitrógeno , observamos que en (a) el nitrógeno El átomo comparte tres pares de enlaces y tiene un par solitario y tiene un total de 5 electrones de valencia. los cargo formal sobre el nitrógeno Por tanto, el átomo es 5 - (2 + 6/2) = 0. En (b), el nitrógeno átomo tiene un cargo formal de -1.
Además, ¿cuál es la carga formal de nitrógeno?
Los electrones de valencia de nitrógeno en sus compuestos están todos los orbitales con hibridación sp³. los cargo formal sobre norte suele ser -1 para un anión, 0 para un compuesto neutro y +1 en cationes. A nitrógeno átomo con un cargo formal de -3 correspondería a un ion nitruro, N $ ³ $ ?, que es fuertemente básico en solución acuosa.
Del mismo modo, ¿cómo se calcula el cargo formal? Cargo formal = [# electrones de valencia en un átomo neutro] - [(# pares de electrones solitarios) + (½ # electrones de enlace)] Electrones de valencia = corresponde al número de grupo de la tabla periódica (para elementos representativos). Pares solitarios = electrones solitarios que se sientan en el átomo. Cada electrón cuenta como uno y así un par cuenta como dos.
También hay que saber cuál es la carga formal de nitrógeno en la imagen proporcionada.
Haga clic en cualquiera imagen para ver la geometría optimizada. los nitrógeno átomo tiene cuatro enlaces con el hidrógeno, dando el nitrógeno átomo un total de 4 electrones de valencia. Atómico nitrógeno tiene 5 electrones de valencia, por lo que (5-4) = +1 y está correctamente etiquetado como un cargo formal de +1.
¿El oxígeno es positivo o negativo?
Un buen ejemplo es un átomo de oxígeno que comparte un electrón con cada uno de los dos cercanos. átomos de hidrógeno , haciendo una molécula de agua H2O. Un átomo de oxígeno que ha donado con éxito uno o dos electrones o que comparte uno o dos electrones ha perdido parte de su carga negativa, por lo que queda cargado positivamente.
Recomendado:
¿Cuál es la configuración electrónica de valencia del núcleo para el nitrógeno?
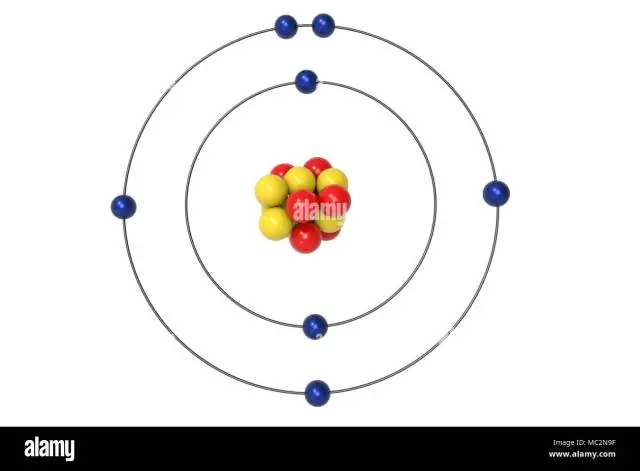
Los tres electrones restantes irán en el orbital 2p. Por lo tanto, la configuración de electrones N será 1s22s22p3. La notación de configuración para el nitrógeno (N) proporciona una manera fácil para que los científicos escriban y comuniquen cómo se organizan los electrones alrededor del núcleo del átomo de nitrógeno
¿Cuál es el proceso mediante el cual los iones nitrato y los iones nitrito se convierten en gas óxido nitroso y gas nitrógeno n2?

Los iones de nitrato y los iones de nitrito se convierten en gas óxido nitroso y gas nitrógeno (N2). Las raíces de las plantas absorben iones de amonio e iones de nitrato para su uso en la fabricación de moléculas como ADN, aminoácidos y proteínas. El nitrógeno orgánico (el nitrógeno en el ADN, aminoácidos, proteínas) se descompone en amoníaco y luego en amonio
¿Qué es la carga por frotamiento y la carga por inducción?

La carga por fricción es un método muy común de cargar un objeto. La carga por inducción es un método que se utiliza para cargar un objeto sin tocar el objeto con ningún otro objeto cargado
¿Qué es carga activa y carga pasiva?

Una carga pasiva es una carga que consta únicamente de una resistencia, condensador o inductor, o una combinación de ellos. Una carga activa es una carga que incluye algo que está controlado por corriente o voltaje, particularmente un dispositivo microconductor. Mis diseños de circuitos deben considerarse experimentales
¿Cuál es el flujo a través de un cubo de lado si una carga puntual de Q está en una de sus esquinas?

Como sabemos, el flujo total de una carga q es q / ε 0 (ley de Gauss). Si la carga está en la esquina de un cubo, parte del flujo ingresa al cubo y sale por algunas de sus caras. Pero parte del flujo no entra en el cubo. Este 1/8 se dividirá nuevamente en 3 partes
