
Tabla de contenido:
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Última modificación 2025-01-22 16:57.
La depresión del punto de congelación es una propiedad coligativa observada en soluciones que resulta de la Introducción de moléculas de soluto a un solvente. Los puntos de congelación de las soluciones son todos más bajos que los del solvente puro y son directamente proporcionales a la molalidad del soluto.
En consecuencia, ¿cómo se calcula la Molalidad a partir de la depresión del punto de congelación?
Estrategia:
- Paso 1: Calcule la depresión del punto de congelación del benceno. TF = (Punto de congelación del disolvente puro) - (Punto de congelación de la solución)
- Paso 2: Calcule la concentración molal de la solución. molalidad = moles de soluto / kg de disolvente.
- Paso 3: Calcule KF de la solución. TF = (KF) (m)
Asimismo, ¿por qué se usa Molality en el punto de congelación? Wendy K. Las propiedades coligativas son propiedades físicas de las soluciones, como la ebullición. punto elevación y punto de congelación depresión. Por eso usamos molalidad (moles de soluto por kg de solvente) ya que el kg de solvente no cambia con temperatura.
También la pregunta es, ¿qué quiere decir con depresión del punto de congelación?
Depresión del punto de congelación ocurre cuando el punto de congelación de un líquido se baja o Deprimido añadiéndole otro compuesto. La solución tiene un menor punto de congelación que la del disolvente puro.
¿Cómo afecta la Molalidad al punto de ebullición?
Cuanto mayor sea la concentración ( molalidad ), cuanto mayor sea el punto de ebullición . Puedes pensar en esto efecto como soluto disuelto desplazando las moléculas de disolvente en la superficie, donde hirviendo ocurre. Por lo tanto, requiere una mayor temperatura para que se escapen suficientes moléculas de disolvente para continuar hirviendo a presión atmosférica.
Recomendado:
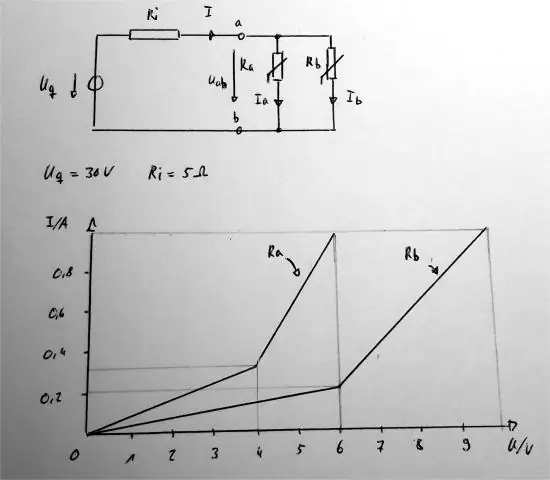
¿Cuál es la relación matemática entre la resistencia de la corriente y el aparato de voltaje?
Ley de Ohm. La relación entre voltaje, corriente y resistencia se describe mediante la ley de Ohm. Esta ecuación, i = v / r, nos dice que la corriente, i, que fluye a través de un circuito es directamente proporcional al voltaje, v, e inversamente proporcional a la resistencia, r
¿Cómo se encuentra la masa molar desde el punto de congelación?

Paso 1: enumere las cantidades conocidas y planifique el problema. Utilice la depresión del punto de liberación egin {align *} (Delta T_f) end {align *} para calcular la molalidad de la solución. Luego usa la ecuación de molalidad para calcular los moles de soluto. Luego divida los gramos de soluto por los moles para determinar la masa molar
¿Cómo se determina el punto de congelación?
Estrategia: Paso 1: Calcule la depresión del punto de congelación del benceno. Tf = (Punto de congelación del disolvente puro) - (Punto de congelación de la solución) Paso 2: Calcule la concentración molal de la solución. molalidad = moles de soluto / kg de disolvente. Paso 3: Calcule el Kf de la solución. Tf = (Kf) (m)
¿Cómo afecta la depresión del punto de congelación al peso molecular?

Por tanto, a medida que aumenta la masa molar, la depresión del punto de congelación disminuye. Es decir, aumentar la masa molar (o molecular) tendrá un efecto menor en el punto de congelación
¿Qué es el punto de fusión y congelación?

Cuando un sólido se convierte en líquido, se denomina fusión. El punto de fusión del agua es de 0 grados C (32 grados F). Cuando sucede lo contrario y un líquido se convierte en sólido, se denomina congelación. Ebullición y condensación. Cuando un líquido se convierte en gas, se llama ebullición o vaporización
