
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:35.
- Última modificación 2025-01-22 16:57.
Note una diferencia clave entre el general diagrama de fases y el diagrama de fases por agua . La razon es que agua es una sustancia inusual porque su estado sólido es menos denso que el estado líquido. El hielo flota en líquido agua . Por lo tanto, un cambio de presión tiene el efecto contrario en esos dos etapas.
Por tanto, ¿en qué se diferencia el diagrama de fases del agua del resto de sustancias?
los diagrama de fases para la mayoría sustancias Se ve como esto. Por tanto, la pendiente negativa indica que el líquido fase tiene una densidad mayor que el sólido fase . En otras palabras, la densidad del hielo es menor que la del hielo. agua . Para la mayoría de los demás sustancias , el sólido es más denso que el líquido.
De manera similar, ¿en qué se diferencian el diagrama de fases para el agua y el dióxido de carbono? diferente a dióxido de carbono y la mayoría de las otras sustancias, la diagrama de fases de agua muestra una pendiente negativa para la línea límite entre el estado líquido y sólido. Esta diferencia tiene que hacer con el hecho de que agua en realidad se expande a medida que pasa del estado líquido al estado sólido.
¿Cuál es el propósito de un diagrama de fases?
A diagrama de fases en química física, ingeniería, mineralogía y ciencia de los materiales es un tipo de gráfico que se utiliza para mostrar las condiciones (presión, temperatura, volumen, etc.) en las que termodinámicamente distintas etapas (como estados sólido, líquido o gaseoso) ocurren y coexisten en equilibrio.
¿Por qué los diagramas de fase son diferentes para cada sustancia?
Al evaluar el diagrama de fases , cabe señalar que el sólido-líquido fase límite en el diagrama de fases de la mayoría sustancias tiene una pendiente positiva. Esto se debe al sólido fase que tiene una densidad más alta que el líquido, de modo que al aumentar la presión aumenta la temperatura de fusión.
Recomendado:
¿Cuál es la actividad del agua del agua pura?

La actividad del agua se basa en una escala de 0 a 1,0, y el agua pura tiene un valor de 1,00. Se define como la presión de vapor de agua sobre una muestra dividida por la presión de vapor de agua pura a la misma temperatura. En otras palabras, cuanta más agua libre tengamos, más probabilidad tenemos de deterioro microbiano
¿Cuál es la composición eutéctica en el diagrama de fases de hierro y carbono?

La concentración eutéctica de carbono es del 4,3%. En la práctica, solo se utilizan aleaciones hipoeutécticas. Estas aleaciones (contenido de carbono del 2,06% al 4,3%) se denominan fundiciones. Cuando la temperatura de una aleación de este rango alcanza los 2097 ºF (1147 ºC), contiene cristales primarios de austenita y una cierta cantidad de la fase líquida
¿Por qué la densidad es una propiedad importante del agua del océano?

La densidad del agua de mar juega un papel vital en la generación de corrientes oceánicas y la circulación de calor debido al hecho de que el agua densa se hunde por debajo de la densa. La salinidad, la temperatura y la profundidad afectan la densidad del agua de mar. La densidad es una medida de qué tan apretada se empaqueta una cierta cantidad de materia en un volumen dado
¿Qué propiedad del agua permite que el agua se pegue al centavo?

cohesión Además, ¿qué propiedad del agua le permite adherirse a sí misma? cohesión Además de arriba, ¿cómo funciona la adhesión con agua? Adhesión se refiere a la tendencia de agua moléculas para ser atraídas, o "pegadas"
¿Por qué el agua tiene un diagrama de fase de pendiente negativa?
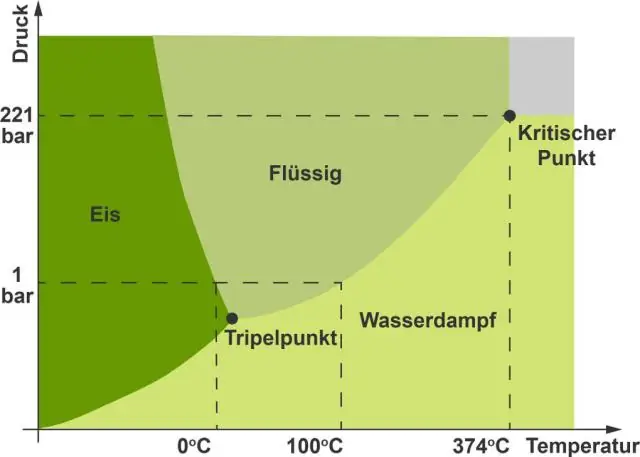
En el diagrama del agua, la pendiente de la línea entre los estados sólido y líquido es negativa en lugar de positiva. La razón es que el agua es una sustancia inusual porque su estado sólido es menos denso que el estado líquido
