
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:35.
- Última modificación 2025-01-22 16:57.
| Temperatura (K) | Cpag (J / mol * K) | H ° - H °298.15 (kJ / mol) |
|---|---|---|
| 298. | 59.52 | -0.00 |
| 300. | 59.67 | 0.12 |
| 400. | 64.94 | 6.34 |
| 500. | 75.16 | 13.29 |
En consecuencia, ¿cuál es la capacidad calorífica específica de HCl y NaOH?
Calor especifico de HCl & NaOH Solución = 4.017 J / g ° C.
Además, ¿cuál es la entalpía de nacl? Entonces, cuando 1 mol de cloruro de sodio Los cristales se disuelven en un exceso de agua, la entalpía se encuentra que el cambio de solución es +3.9 kJ mol-1. El cambio es ligeramente endotérmico, por lo que la temperatura de la solución será ligeramente más baja que la del agua original.
Asimismo, ¿cuáles son los usos del hidróxido de sodio?
- Es el ingrediente principal en limpiadores de desagües y hornos.
- Se utiliza en la fabricación de productos químicos, refinación de petróleo, fracturación hidráulica, tratamiento de agua y procesamiento de metales.
- Se utiliza en la fabricación de telas, envoltorios de plástico, papel y jabón.
¿Cómo se calcula la capacidad calorífica específica?
Las unidades de capacidad calorífica específica son J / (kg ° C) o equivalentemente J / (kg K). los capacidad calorífica y el calor especifico están relacionados por C = cm oc = C / m. La masa m, calor especifico c, cambio de temperatura ΔT, y calor Sumados (o restados) Q están relacionados por el ecuación : Q = mcΔT.
Recomendado:
¿Cuál es la capacidad calorífica específica del octano?

Nombres de octano Capacidad calorífica (C) 255,68 J K − 1 mol − 1 Entropía molar estándar (So298) 361,20 J K − 1 mol − 1 Entalpía estándar de formación (Δ fH? 298) − 252,1– − 248,5 kJ mol − 1 Entalpía estándar de combustión (Δ cH? 298) − 5.53– − 5.33 MJ mol − 1
¿Cómo calculamos la capacidad calorífica específica?
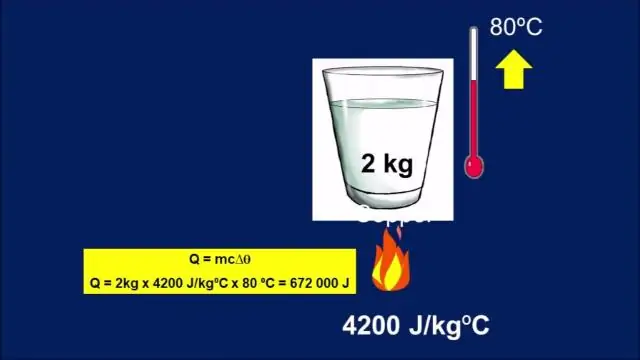
Las unidades de capacidad calorífica específica son J / (kg ° C) o equivalentemente J / (kg K). La capacidad calorífica y el calor específico están relacionados por C = cm oc = C / m. La masa m, el calor específico c, el cambio de temperatura Δ T y el calor añadido (o sustraído) Q están relacionados por la ecuación: Q = mc Δ T
¿Cuál es la capacidad calorífica específica de la cerámica?

Los materiales cerámicos como el hormigón o el ladrillo tienen capacidades caloríficas específicas de alrededor de 850 J kg-1 K-1
¿Cuál es la unidad SI correcta para la capacidad calorífica?

Conclusiones clave: capacidad calorífica específica En unidades del SI, la capacidad calorífica específica (símbolo: c) es la cantidad de calor en julios necesaria para elevar 1 gramo de una sustancia a 1 Kelvin. También puede expresarse como J / kg · K. La capacidad calorífica específica también se puede informar en unidades de calorías por gramo grado Celsius
¿Cuál es la capacidad calorífica de un objeto?

La capacidad calorífica, o 'masa térmica' de un objeto, se define como la energía en julios requerida para elevar la temperatura de un objeto dado en 1 ° C. Este es el 'calor específico' del objeto (una propiedad física / química definida ) multiplicado por su masa y el cambio de temperatura
