
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:35.
- Última modificación 2025-06-01 05:04.
Unión covalente es el tipo de enlace que mantiene unidos a los átomos dentro de un ion poliatómico. Se necesitan dos electrones para hacer un enlace covalente , uno de cada átomo de enlace. Las estructuras de puntos de Lewis son una forma de representar cómo se forman los átomos enlaces covalentes.
Del mismo modo, ¿cómo se combinan los iones poliatómicos?
Otra forma de formar iones poliatómicos es por combinatorio ellos con uno o más hidrógeno iones , H+. Por ejemplo, podríamos combinar H+ con carbonato, CO32- para formar carbonato de hidrógeno, HCO3-. Observe que la carga general es 1- porque el 1+ en H+ combinar con el 2 en CO32-.
También se puede preguntar, ¿los compuestos con iones poliatómicos son iónicos o covalentes? Iones poliatómicos están iones . Sin embargo, los átomos en iones poliatómicos se mantienen unidos por covalente cautiverio. Compuestos conteniendo iones poliatómicos están Compuestos iónicos . La regla básica es Compuestos iónicos tener lugar entre un positivo iónico metal y un negativo iónico no metal.
Además de esto, ¿qué combinación de elementos formará un enlace iónico?
Un enlace iónico es un tipo de químico vínculo formado a través de una atracción electrostática entre dos cargados opuestamente iones . Enlaces iónicos se forman entre un catión, que suele ser un metal, y un anión, que suele ser un no metal. Un covalente vínculo implica un par de electrones que se comparten entre átomos.
¿Qué dos elementos tienen más probabilidades de vincularse entre sí?
Oxígeno (O) y flúor (F) son dos buenos ejemplos. Cada uno de esos elementos busca un par de electrones para formar una capa llena. Cada uno tiene una capa llena con dos electrones, pero sus segundas capas quieren tener ocho.
Recomendado:
¿Cuál es el proceso mediante el cual los iones nitrato y los iones nitrito se convierten en gas óxido nitroso y gas nitrógeno n2?

Los iones de nitrato y los iones de nitrito se convierten en gas óxido nitroso y gas nitrógeno (N2). Las raíces de las plantas absorben iones de amonio e iones de nitrato para su uso en la fabricación de moléculas como ADN, aminoácidos y proteínas. El nitrógeno orgánico (el nitrógeno en el ADN, aminoácidos, proteínas) se descompone en amoníaco y luego en amonio
¿Por qué se mantienen unidos los pares de bases complementarios?

Los nucleótidos en un par de bases son complementarios, lo que significa que su forma les permite unirse con enlaces de hidrógeno. El par A-T forma dos enlaces de hidrógeno. El par C-G forma tres. El enlace de hidrógeno entre bases complementarias mantiene unidas las dos cadenas de ADN
¿Cuál es la fuerza de atracción que mantiene unidos a los átomos o iones?

Enlaces químicos
¿Cuáles son los iones poliatómicos comunes?

Iones poliatómicos comunes Zn2 + Zinc. Cd2 + Cadmio. 1+ carga. NH4. Amonio. Hg2. Mercurio (I) Ag + Plata. 1- carga. C2H3O2. Acetato. CN- Cianuro. ClO- hipoclorito. ClO2. Clorita. ClO3. Clorato. ClO4. Perclorato. HCO3. (Bi) carbonato de hidrógeno. H2PO4
¿Cómo se enlazan los iones poliatómicos?
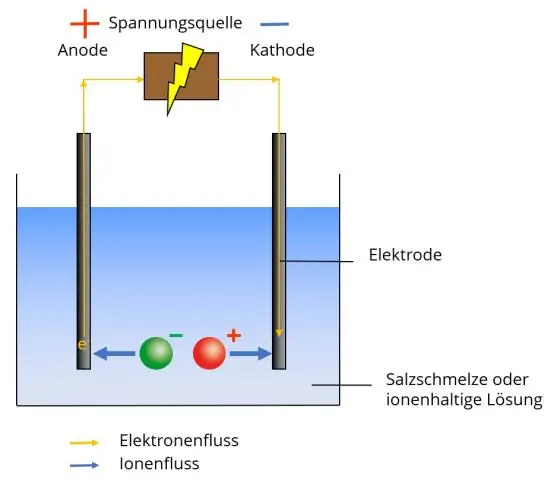
Un ion poliatómico tiene dos o más átomos unidos covalentemente que actúan como un solo ion. El ion poliatómico forma enlaces iónicos con otros iones y actúa externamente como una unidad, al igual que los iones monoatómicos
