
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Última modificación 2025-01-22 16:57.
El cloro isótopo con 18 neutrones tiene una abundancia de 0,7577 y un número másico de 35 amu. Para calcular el promedio masa atómica, multiplica la fracción por el número de masa de cada isótopo , luego agréguelos.
De manera similar, ¿cuál es el promedio ponderado de todos los isótopos de un elemento?
Usando las masas de los diferentes isótopos y que abundante cada isótopo es, podemos encontrar el promedio masa de los átomos de un elemento . La masa atómica de un elemento es el peso promedio masa de los átomos en una muestra natural del elemento . La masa atómica se expresa típicamente en unidades de masa atómica.
¿Qué tiene una masa de 1 amu? Una unidad de masa atómica (simbolizada AMU o amu) se define exactamente como 1/12 de la masa de un átomo de carbono-12. El átomo de carbono-12 (C-12) tiene seis protones y seis neutrones en su núcleo. En términos imprecisos, una UMA es el promedio de la protón masa de descanso y el neutrón masa de descanso.
En segundo lugar, ¿cómo se calcula el porcentaje de abundancia utilizando la masa atómica?
Cambiar cada uno porcentaje de abundancia en forma decimal dividiendo por 100. Multiplique este valor por el masa atomica de ese isótopo. Suma para cada isótopo para obtener el promedio masa atomica.
¿Cuál es la diferencia entre masa atómica y peso atómico?
Masa atomica (metroa) es el masa de un átomo . Un solo átomo tiene un número determinado de protones y neutrones, por lo que el masa es inequívoco (no cambiará) y es la suma del número de protones y neutrones en el átomo . Peso atomico es un promedio ponderado de la masa de todos los átomos de un elemento, basado en la abundancia de isótopos.
Recomendado:
¿Qué es un ponderado?

La ponderación A es una curva (o filtro) dependiente de la frecuencia que se aplica a las mediciones del micrófono de presión sonora para imitar los efectos de la audición humana. Dados los mismos niveles de presión sonora, las grabaciones de micrófono pueden ser muy diferentes a los niveles percibidos por el oído humano (Figura 1)
¿Cómo hallas la velocidad promedio con dos velocidades?
La suma de la velocidad inicial y final se divide por 2 para encontrar el promedio. La calculadora de velocidad promedio usa la fórmula que muestra que la velocidad promedio (v) es igual a la suma de la velocidad final (v) y la velocidad inicial (u), dividida por 2
¿Cómo se calcula la masa atómica promedio del estroncio?
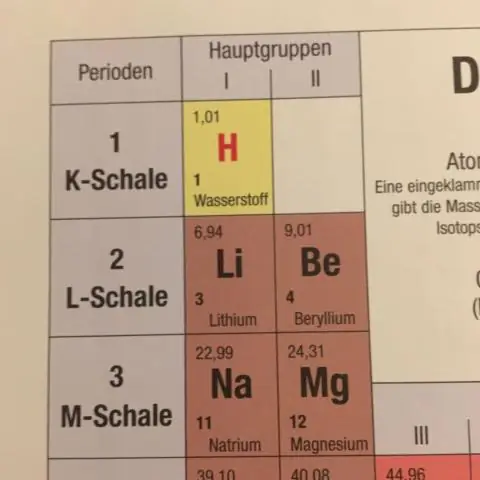
Entonces, lo calculamos tomando la masa ponderada de cada uno de los isótopos y sumándolos. Entonces, para la primera masa, multiplicaremos 0.50% de 84 (amu - unidades de masa atómica) = 0.042 amu, y lo sumaremos al 9.9% de 86 amu = 8.51 amu, y así sucesivamente
¿Cómo se crea un promedio ponderado en una tabla dinámica?

Promedios ponderados en una tabla dinámica Haga clic en la flecha hacia abajo junto a la palabra Tabla dinámica en el lado izquierdo de la barra de herramientas de la tabla dinámica. Elija fórmulas | Campos calculados. En el cuadro Nombre, ingrese un nombre para su nuevo campo. En el cuadro Fórmula, ingrese la fórmula que desea utilizar para su promedio ponderado, como = Valor ponderado / Peso. Haga clic en Aceptar
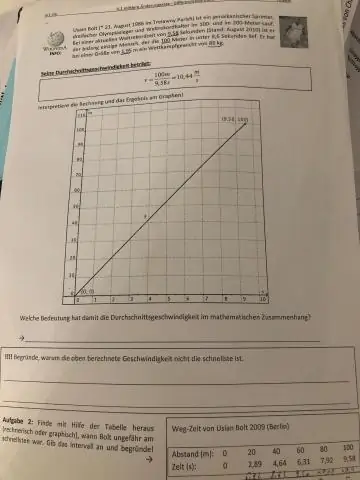
¿Cómo se encuentra la velocidad promedio en un gráfico de velocidad en función del tiempo?

El área bajo la curva de velocidad / tiempo es el desplazamiento total. Si divide eso por el cambio en el tiempo, obtendrá la velocidad promedio. La velocidad es la forma vectorial de la velocidad. Si la velocidad siempre es no negativa, entonces la velocidad promedio y la velocidad promedio son iguales
