
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:35.
- Última modificación 2025-01-22 16:57.
En física y química, el Serie Lyman es un espectral de hidrógeno serie de transiciones y resultantes ultravioleta emisión líneas del átomo de hidrógeno como electrón va de n ≧ 2 an = 1 (donde n es el número cuántico principal), el nivel de energía más bajo del electrón.
De esta forma, ¿qué hay en una región ultravioleta?
Lyman serie del átomo de hidrógeno mentiras en el región ultravioleta , Balmer la serie se encuentra en la región visible , Paschen mentiras de la serie en infrarrojo cercano región mientras que Bracket, Pfund y Humphrey mentira de la serie en infrarrojo lejano región del espectro electromagnético.
Además, ¿en qué región aparecen las series Lyman y Paschen? Respuesta: Explicación: Serie Paschen cae en el infrarrojo región de radiación electromagnética.
De manera similar, uno puede preguntarse, ¿qué serie de espectro de hidrógeno se encuentra en la región UV?
El Lyman mentiras de la serie en el Región ultravioleta . El balmer mentiras de la serie en lo visible región . Paschen, Brackett y Pfund mentira de la serie en el infrarrojo región.
¿A qué transiciones corresponden las líneas de la serie Lyman?
La llamada Serie Lyman de líneas en el espectro de emisión de hidrógeno corresponde a las transiciones desde varios estados excitados hasta la órbita n = 1.
Recomendado:
¿Qué es una comunidad de plantas y animales que se encuentra en una región en particular?

Definiciones de ecología Término Definición Biodiversidad La variedad de diferentes especies presentes en la comunidad de un ecosistema Bioma Regiones del planeta que se caracterizan por su clima y contienen comunidades distintivas de plantas y animales Comunidad Todos los organismos presentes en un ecosistema
¿Qué serie se encuentra en la región infrarroja?

La región del infrarrojo lejano se conoce como serie Pfund. La región del infrarrojo muy lejano se conoce como serie de Humphrey. Respuesta: La serie de líneas en el espectro de hidrógeno que se encuentran en la región infrarroja son las líneas Paschen, las líneas Brackett y las líneas Pfund
¿Qué tipo de vegetación se encuentra en la región árida?

La zona árida (índice árido 0,03-0,20) se caracteriza por el pastoreo y no agricultura excepto con riego. En su mayor parte, la vegetación nativa es escasa, compuesta por pastos anuales y perennes y otra vegetación herbácea, y arbustos y árboles pequeños
¿Cómo se encuentra la suma de una serie geométrica o aritmética finita?
La fórmula para la suma de n términos de una secuencia geométrica viene dada por Sn = a [(r ^ n - 1) / (r - 1)], donde a es el primer término, n es el número del término y r es el razón común
¿Cuál es la diferencia entre la región tropical y la región templada?
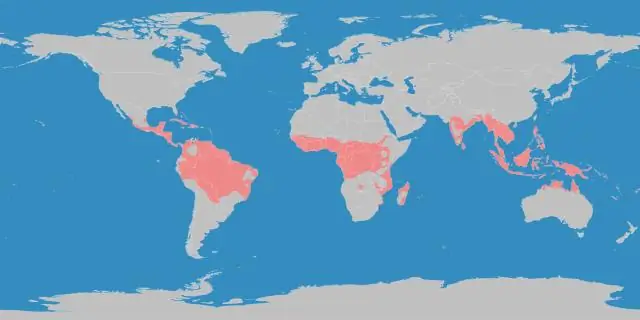
Región tropical significa la región que siempre tiene una temperatura de 65 grados F o más. típicamente, la ubicación de estos están cerca del ecuador terrestre. en la región templada, hay variación de temperatura pero no extrema de frío o calor. Por lo general, la ubicación de estos se encuentra a medio camino entre el ecuador y el polo
