
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Última modificación 2025-01-22 16:57.
La presencia de sólo ciertas líneas en atómica espectros significaba que un electrón solo puede adoptar ciertos niveles de energía discretos (la energía está cuantificada); de ahí la idea de cuántico conchas . Las frecuencias de fotones absorbidas o emitido por un átomo están fijados por las diferencias entre los niveles de energía de las órbitas.
Con respecto a esto, ¿cómo explica el modelo de Bohr los espectros de emisión de los átomos?
El modelo de Bohr del hidrogeno átomo dio una explicación exacta de su observado espectro de emisión . Los electrones pueden moverse de una órbita a otra absorbiendo o emitiendo energía, dando lugar a características espectros.
¿Qué evidencia respalda el modelo de Bohr? Modelo de Bohr y espectros atómicos evidencia solía hacerlo apoyar el modelo de Bohr vino de los espectros atómicos. Bohr sugirió que se crea un espectro atómico cuando los electrones en un átomo se mueven entre niveles de energía.
Con respecto a esto, ¿qué evidencia hay de electrones en las capas?
Energía de ionización - la evidencia por conchas y sub- conchas La energía de ionización es a medida de los cantidad de energía necesaria para eliminar electrones de los átomos. Como electrones tienen carga negativa y protones en los los núcleos están cargados positivamente, allí será una atracción entre ellos.
¿Cómo encuentras el espectro de emisión?
Las frecuencias de la luz que puede emitir un átomo dependen de los estados en los que pueden estar los electrones. Cuando se excita, un electrón se mueve a un nivel de energía u orbital superior. Cuando el electrón vuelve a su nivel del suelo, la luz se ilumina. emitido.
Recomendado:
¿Por qué los electrones más externos son los únicos incluidos en el diagrama de puntos de electrones?

Los átomos con 5 o más electrones de valencia ganan electrones formando un ión negativo o anión. ¿Por qué los electrones más externos solo están incluidos en el diagrama de llenado orbital? son los únicos involucrados en reacciones químicas y enlaces. El orbital 2s está más lejos del núcleo, lo que significa que tiene más energía
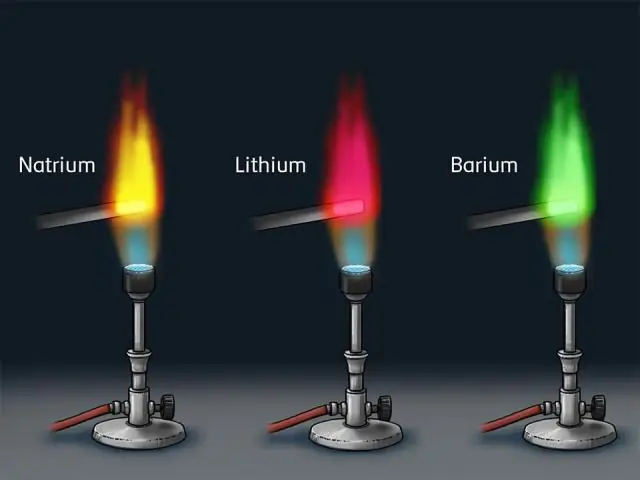
¿Cómo producen los átomos los espectros de líneas brillantes?

Es producido por los electrones en los átomos de los elementos que saltan a estados de energía más bajos después de haber sido empujados hacia arriba por una colisión con otro átomo o un fotón o electrón entrante o lo que sea. Al hacerlo, liberan su energía extra al irradiar fotones, generalmente un fotón por transición
¿Cómo se evidencian los espectros de emisión de las capas de electrones?

La presencia de solo ciertas líneas en los espectros atómicos significaba que un electrón solo puede adoptar ciertos niveles de energía discretos (la energía está cuantificada); de ahí la idea de las capas cuánticas. Las frecuencias de los fotones absorbidos o emitidos por un átomo están fijadas por las diferencias entre los niveles de energía de las órbitas
¿Cómo describió Niels Bohr los electrones en su modelo atómico?
Modelo atómico de Bohr: En 1913, Bohr propuso su modelo de capa cuantificado del átomo para explicar cómo los electrones pueden tener órbitas estables alrededor del núcleo. La energía de un electrón depende del tamaño de la órbita y es menor para órbitas más pequeñas. La radiación puede ocurrir solo cuando el electrón salta de una órbita a otra
¿Cómo explica el modelo de Bohr los espectros atómicos?

Niels Bohr explicó el espectro lineal del átomo de hidrógeno asumiendo que el electrón se movía en órbitas circulares y que se permitían órbitas con solo ciertos radios. La órbita más cercana al núcleo representaba el estado fundamental del átomo y era la más estable; Las órbitas más lejanas eran estados excitados de mayor energía
