
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Última modificación 2025-01-22 16:57.
Niels Bohr explicó los espectro de línea del hidrogeno átomo asumiendo que el electrón se movía en órbitas circulares y que se permitían órbitas con sólo ciertos radios. La órbita más cercana al núcleo representaba el estado fundamental del átomo y era más estable; las órbitas más lejanas eran estados excitados de mayor energía.
De manera similar, ¿qué explica el modelo de Bohr?
los Modelo de Bohr muestra que los electrones en los átomos están en órbitas de diferente energía alrededor del núcleo (piense en planetas que orbitan alrededor del sol). Bohr Usó el término niveles de energía (o capas) para describir estas órbitas de diferente energía.
Además, ¿cómo se lee un modelo de Bohr?
- Dibuja el núcleo.
- Escribe el número de neutrones y el número de protones en el núcleo.
- Dibuja el primer nivel de energía.
- Dibuja los electrones en los niveles de energía de acuerdo con las siguientes reglas.
- Lleve un registro de cuántos electrones se colocan en cada nivel y la cantidad de electrones que quedan por usar.
De manera similar, uno puede preguntarse, ¿cómo se produce un espectro atómico?
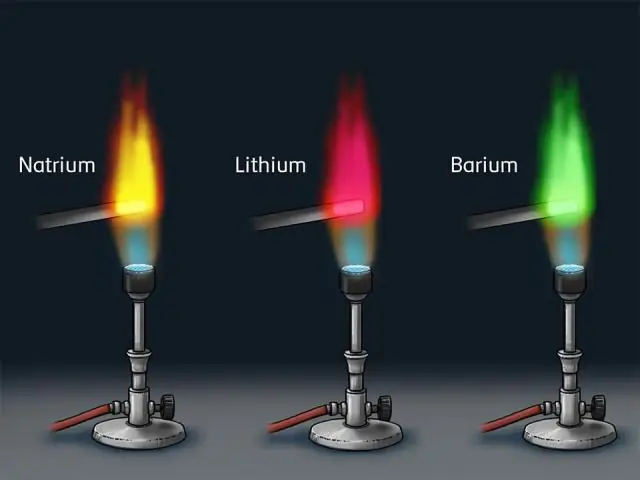
Cuando átomos están excitados emiten luz de ciertas longitudes de onda que corresponden a diferentes colores. La luz emitida se puede observar como una serie de líneas coloreadas con espacios oscuros en el medio; esta serie de líneas coloreadas se llama línea o Espectro atomico . Cada elemento produce un conjunto único de espectral líneas.
¿Cuál es la conclusión a la que llegó Bohr en su modelo para explicar el espectro lineal del hidrógeno?
Explicación: Bohr basó esta suposición en el hecho de que sólo hay unos pocos líneas en el espectro de El hidrógeno átomo y creía que el líneas eran el resultado de la liberación o absorción de luz cuando un electrón se movía de una órbita a otra en el átomo.
Recomendado:
¿Cómo los espectros de emisión son evidencia de capas de electrones en el modelo de Bohr?

La presencia de solo ciertas líneas en los espectros atómicos significaba que un electrón solo puede adoptar ciertos niveles de energía discretos (la energía está cuantificada); de ahí la idea de las capas cuánticas. Las frecuencias de los fotones absorbidos o emitidos por un átomo están fijadas por las diferencias entre los niveles de energía de las órbitas
¿Cómo producen los átomos los espectros de líneas brillantes?

Es producido por los electrones en los átomos de los elementos que saltan a estados de energía más bajos después de haber sido empujados hacia arriba por una colisión con otro átomo o un fotón o electrón entrante o lo que sea. Al hacerlo, liberan su energía extra al irradiar fotones, generalmente un fotón por transición
¿Por qué podría llamarse al modelo de Bohr un modelo planetario del átomo?

La razón por la que se llama 'modelo planetario' es que los electrones se mueven alrededor del núcleo de manera muy similar a como los planetas se mueven alrededor del sol (excepto que los planetas se mantienen cerca del sol por la gravedad, mientras que los electrones se mantienen cerca del núcleo por algo llamado una fuerza de Coulomb)
¿Cómo explica el modelo del faro los púlsares?

Explica los púlsares como estrellas de neutrones en rotación que emiten rayos de radiación desde sus polos magnéticos. Mientras giran, barren los rayos alrededor del cielo como faros; si los rayos barren la Tierra, los astrónomos detectan pulsos. Cuando una supernova explota, el núcleo se colapsa a un tamaño muy pequeño
¿Cómo describió Niels Bohr los electrones en su modelo atómico?
Modelo atómico de Bohr: En 1913, Bohr propuso su modelo de capa cuantificado del átomo para explicar cómo los electrones pueden tener órbitas estables alrededor del núcleo. La energía de un electrón depende del tamaño de la órbita y es menor para órbitas más pequeñas. La radiación puede ocurrir solo cuando el electrón salta de una órbita a otra
